contoh soal hukum raoult

Hai netizen semoga kalian lagi bugar, Sekarang ini aku mau memberitahu informasi tentang contoh soal hukum raoult lengkap dengan isi didalamnya. Akan tetapi sebelum menuju kepada konten contoh soal hukum raoult ada bagusnya kita tengok dulu tentang contoh soal hukum raoult tersebut.
contoh soal hukum raoult memang sedang hits diperbincangkan saat ini, Mengingat contoh soal hukum raoult yang mau aku bagikan ini sangat lengkap dengan informasi selengkapnya. Saat ini banyak sekali teknologi yang begitu canggih, bisa dari Smartphone yang agan miliki sangat bisa melakukan apapun di tangan yang kamu pegang itu. Mau itu mencari pasar,orang luar,konten aneh semuanya ada di tangan kalian.
Pembahasan kali ini juga ialah bagian dari konten yang sudah hits di dunia internet yang kamu pegang. Tentunya pembahasan yang akan aku bagikan sangat berbeda dari situs yang lainnya, Sangat cetar membahana dan menjanjikan.
Sepertinya tidak perlu lama lagi, langsung saja ke pembahasan utamanya, Berikut informasi contoh soal hukum raoult lengkap dengan gambarnya.

Contoh sehari-hari ini diberikan oleh pengalaman seseorang dengan minuman ringan berkarbonasi, yang berisi karbon dioksida terlarut. Sebelum dibuka, gas di atas minuman dalam wadah adalah karbon dioksida yang hampir murni, pada tekanan yang lebih tinggi dari tekanan atmosfer.
Ada berbagai cara untuk mendefinisikan konstanta kesebandingan hukum Henry, yang dapat dibagi menjadi dua jenis dasar: Salah satu kemungkinannya adalah untuk menempatkan fase air menjadi pembilang dan fase gas menjadi penyebut (“aq/gas”).
Hal ini tidak memungkinkan untuk menggunakan rasio pencampuran dari fase gas () karena pada rasio pencampuran fase gas tertentu, konsentrasi fase berair tergantung pada tekanan total dan dengan demikian rasio bukanlah suatu konstanta.

Hukum Henry menetapkan hubungan antara tekanan parsial gas murni dalam kesetimbangan dengan larutan yang juga berisi bahan murni dalam keadaan cair dalam proporsi yang signifikan. Hukum Raoult, tidak ada pelarut yang lebih mendominasi. Dua komponen murni dari campuran yang dalam proporsi yang sama besarnya.
Hukum Henry adalah hukum terbatas yang hanya berlaku untuk larutan yang “cukup encer”. Kisaran konsentrasi yang berlaku menjadi sempit bila semakin banyak sistem yang menyimpang dari perilaku ideal. Secara kasar, yaitu semakin zat terlarut secara kimiawi “berbeda” lebih dari pelarut.
Contoh soal ini menunjukkan bagaimana menggunakan Hukum Raoult untuk menghitung perubahan tekanan uap dengan menambahkan elektrolit kuat ke pelarut. Hukum Raoult menghubungkan tekanan uap larutan dengan fraksi mol zat terlarut yang ditambahkan ke larutan kimia.

Berapakah perubahan tekanan uap ketika 52,9 g CuCl 2 ditambahkan ke 800 mL H2O pada 52,0 °C. Tekanan uap H 2 O murni pada 52,0 °C adalah 102,1 torr Massa jenis H 2 O pada 52,0 °C adalah 0,987 g/mL.
Hukum Raoult dapat digunakan untuk menyatakan hubungan tekanan uap larutan yang mengandung pelarut volatil dan nonvolatil. Hukum Raoult dinyatakan dengan P larutan = pelarut P 0 pelarut dimana P larutan adalah tekanan uap larutan pelarut adalah fraksi mol pelarut P 0 pelarut adalah tekanan uap pelarut murni
Tentukan fraksi mol larutan CuCl 2 yang merupakan elektrolit kuat . Ini akan sepenuhnya terdisosiasi menjadi ion dalam air dengan reaksi: CuCl 2 (s) → Cu 2+ (aq) + 2 Cl - Ini berarti kita akan memiliki 3 mol zat terlarut yang ditambahkan untuk setiap mol CuCl 2 yang ditambahkan. Dari tabel periodik : Cu = 63,55 g/mol Cl = 35,45 g/mol berat mol CuCl 2 = 63,55 + 2(35,45) g/mol berat mol CuCl 2 = 63,55 + 70,9 g/mol berat mol CuCl 2 = 134,45 g/molmol CuCl 2 = 52,9 gx 1 mol/134,45 g mol CuCl 2 = 0,39 mol Jumlah mol zat terlarut = 3 x (0,39 mol) Jumlah mol zat terlarut = 1,18 mol berat molar air = 2(1)+16 g/mol berat molar air = 18 g/mol massa jenis air = massa air /volume air massa air = massa jenis air x volume massa air massa air = 0,987 g/mL x 800 mL massa air = 789,6 g mol air = 789,6 gx 1 mol/18 g mol air= 43,87 mol larutan = n air /(n air + n zat terlarut ) larutan = 43,87 /(43,87 + 1,18) larutan = 43,87 /45,08 larutan = 0,97

























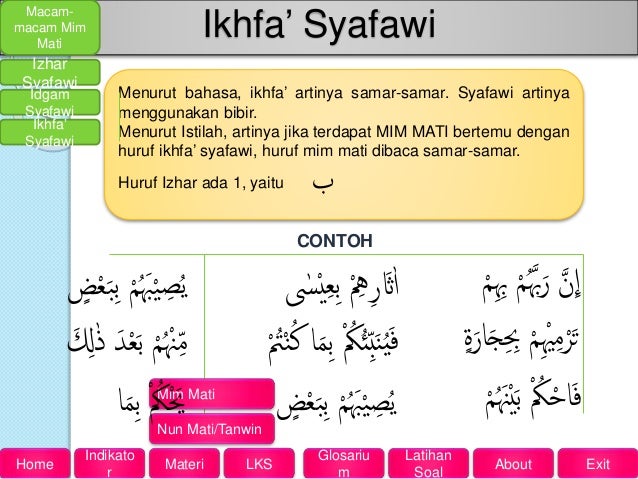






























































Oke, sesuai bukan artikelnya?. Kalau netizen ada pertanyaan tentang contoh soal hukum raoult lebih dalam lagi, agan bisa kasih solusi di kolom komentar untuk memperbaiki lagi website saya ini yang baru tahap newbie. Saya harap sangat bersyukur dengan adanya topik tentang contoh soal hukum raoult ini, para abang dan nyonya permasalahannya bisa teratasi dan terhibur berkat adanya tulisan ini.
Sekian dari aku, Semoga konten tentang contoh soal hukum raoult tersebut bisa bermanfaat bagi kalian semuanya. Ending kata. Thank You untuk semuanya.
Posting Komentar untuk "contoh soal hukum raoult"